瘤内菌群新发现:具核梭杆菌策反中性粒细胞,助推胃癌进展与免疫逃逸
2025-09-25
胃癌是全球第五大常见癌症,占所有癌症病例的约5.6%,同时是癌症致死的第四大原因,相关死亡占比达7.7%。当前胃癌的早期诊断和治疗策略仍显不足。近年研究发现,除幽门螺杆菌外,其他微生物群落也可能参与胃癌进展。
肿瘤内微生物群如何影响胃癌恶性进展及肿瘤免疫微环境(TIME)目前尚不明确。近年研究逐渐聚焦于瘤内菌群与TIME之间的交互作用,尤其是肿瘤相关中性粒细胞(TAN)在肿瘤进展中的功能。TAN可分为抗肿瘤的N1亚型和促肿瘤的N2亚型,其在TIME调控及免疫应答中具有重要作用,但其与菌群互作在胃癌中的作用机制仍待深入揭示。
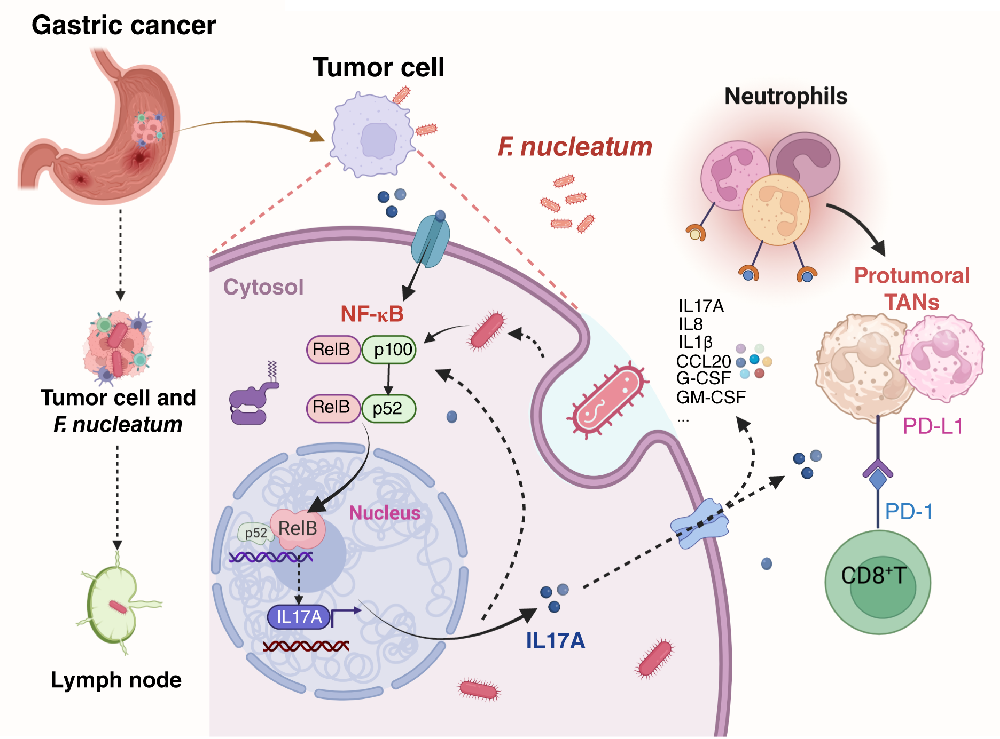
本研究重点关注瘤内微生物群对胃癌进展及TIME的潜在影响。结果表明,具核梭杆菌(F. nucleatum)作为一种非幽门螺杆菌的病原体,可促进胃癌免疫逃逸并增强免疫治疗响应。该菌为革兰阴性厌氧菌,常见于口腔,与牙周病及多种癌症相关。本研究显示,具核梭杆菌能够侵入胃癌细胞并激活IL17信号通路,进而促进中性粒细胞募集和PD-L1+ TAN分化,导致CD8+ T细胞耗竭,从而推动免疫逃逸并增强PD-L1免疫治疗的疗效。
这种藏在胃癌组织的细菌,与转移和预后都有关
为了探究胃癌进展背后的关键微生物,研究者通过16S rRNA扩增子测序、qRT-PCR和FISH技术,对一组胃癌患者(队列1,n=40)的正常胃黏膜组织、癌组织及淋巴结组织中的微生物组成进行分析。结果表明,与正常组织相比,胃癌病灶中梭杆菌属(尤其是具核梭杆菌)显著富集,且在已有淋巴结转移的患者中更为明显,提示该菌可能与胃癌细胞的定植过程相关。16S rRNA和FISH结果均显示,具核梭杆菌在胃周淋巴结中的富集程度甚至高于癌组织本身。进一步生存分析显示,在队列1中具核梭杆菌高富集的患者无进展生存期(PFS)更短,在另一独立队列(队列2,n=93)中也验证出其与总生存期(OS)缩短显著相关:具核梭杆菌阳性患者中位生存期为31.5个月,而阴性患者为46个月。CT/PET-CT影像检查也表明,该菌高富集的患者术后更易出现复发和转移。此外,队列2的临床相关性分析显示,具核梭杆菌富集程度较高的患者,其T分期、N分期和TNM分期也普遍更高。所有这些数据都表明,具核梭杆菌与胃癌恶性进展密切相关。
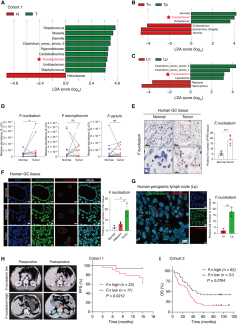
图1 胃癌病灶中梭杆菌属显著富集
具核梭杆菌的“潜伏攻击”机制
为了探究具核梭杆菌在胃癌恶性进展中的作用,研究者首先通过给C57BL/6小鼠灌胃幽门螺杆菌12个月建立原发胃癌模型,再灌胃具核梭杆菌观察其对胃黏膜异型增生和淋巴结转移的影响。结果显示,与大肠杆菌组相比,具核梭杆菌感染明显加剧了胃癌进程:胃组织出现显著异型增生,细胞核增大、极性紊乱,Ki67表达升高;胃周淋巴结肿大、灰变硬质,并有肿瘤细胞浸润,小鼠总体生存时间也显著缩短。
研究还发现,具核梭杆菌能在胃黏膜中定植,单独灌胃该菌三个月即可引发更严重的慢性萎缩性胃炎。在免疫正常小鼠皮下接种胃癌细胞后,具核梭杆菌感染组肿瘤生长更快、Ki67表达更高,但在免疫缺陷鼠中未见差异,提示该菌可能通过调控肿瘤免疫微环境(TIME)促进进展。
此外,通过足垫-腘窝淋巴结转移模型和尾静脉-肺转移模型,进一步证实具核梭杆菌显著增强了胃癌细胞的淋巴转移和远处转移能力,并导致生存期缩短。体外实验显示该菌并不直接促进癌细胞增殖,但在口服该菌的免疫正常鼠移植瘤模型中,肿瘤恶性增殖明显增强。这些结果表明,具核梭杆菌通过定植胃黏膜、改变TIME,进而促进胃癌的发生、发展和转移。
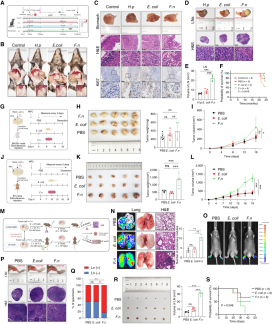
图2 具核梭杆菌促进胃癌恶性进展
具核梭杆菌潜入胃癌细胞内部,促进癌症恶化和淋巴结转移
为了探究具核梭杆菌如何影响胃癌细胞,研究者将细菌与细胞共培养并观察其定位。扫描电镜结果显示,具核梭杆菌会附着在胃癌细胞膜表面;共聚焦荧光显微镜显示细菌聚集在细胞周围,三维立体成像证实两者处于同一立体空间;受感染后的胃癌细胞膜还出现囊状突起,表明细菌不仅附着,更改变了细胞膜形态。透射电镜则在细胞质内发现了具核梭杆菌——它们结构完整、细胞壁完好,并在侵入时诱发细胞膜形成指状结构,类似内吞现象。为明确其侵入机制,活细胞荧光成像显示细菌借助细胞膜表面的囊状结构进入细胞,且被感染的细胞仍保持活性。抗生素实验表明,具核梭杆菌能在不可穿透细胞的抗生素环境下存活,却会被可进入细胞的抗生素杀灭。而使用内吞抑制剂(EIPA、金雀异黄素、氯丙嗪)处理后,细胞内细菌数量显著减少,提示其通过内吞途径入侵。进一步研究发现,细胞内定居的具核梭杆菌会促进胃癌恶性进展:在动物实验中,用内吞抑制剂预处理细胞后再接种细菌,显著减弱了具核梭杆菌的促瘤作用。更引人注目的是,在淋巴结转移模型中,通过荧光原位杂交(FISH)和透射电镜均在淋巴结中检测到具核梭杆菌,细菌培养也证实活的细菌可借助细胞内定植的方式从原发瘤迁移至淋巴结。这些结果表明,具核梭杆菌通过内吞作用侵入胃癌细胞,实现细胞内寄生,并介导胃癌恶化与淋巴结转移。
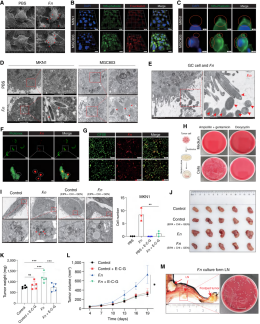
图3 具核梭杆菌在胃癌细胞中定植
中性粒细胞是癌症进展的幕后推手
为了探究具核梭杆菌对胃癌肿瘤微环境的影响,研究者构建了免疫正常小鼠的皮下肿瘤模型,并进行单细胞转录组测序(scRNA-seq)。结果显示,感染该菌的小鼠肿瘤中中性粒细胞比例显著升高,超过对照组三倍以上,且在感染后期进一步上升;而B细胞/浆细胞等具有抗肿瘤功能的免疫细胞则明显减少。这一现象也在免疫组化(IHC)、多重免疫荧光(MIF)和流式细胞术中得到验证。
深入分析发现,肿瘤浸润中性粒细胞存在高度异质性,可分为9个亚群。在具核梭杆菌感染后,部分中性粒细胞亚群(如Sell⁺、Isg15⁺等)比例下降,而Gbe⁺、Wfdc21⁺等亚群显著增加,表明该菌诱导中性粒细胞向促肿瘤表型分化。此外,感染组中性粒细胞与其他免疫细胞之间的相互作用网络明显增强。
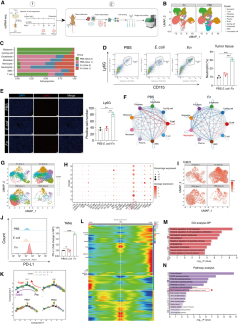
图4 具核梭杆菌感染的胃癌细胞诱导TAN募集与分化
研究还发现,在具核梭杆菌感染背景下,中性粒细胞表面免疫抑制分子PD-L1表达显著上升,且其富集区域中CD8⁺ T细胞数量异常增多。当中性粒细胞被清除后,肿瘤体积和转移率明显下降,CD8⁺ T细胞比例也回落,说明该菌主要通过招募中性粒细胞来重塑免疫微环境、促进肿瘤进展。
体外实验进一步证实,用感染具核梭杆菌的胃癌细胞培养上清处理可显著增强中性粒细胞的迁移能力;而使用内吞抑制剂或多西环素处理则抑制该效应,表明细菌进入细胞内部是促进中性粒细胞招募的关键环节。细胞剔除实验进一步证实,中性粒细胞缺失可显著缓解肿瘤的免疫抑制状态。该研究提示靶向中性粒细胞或具核梭杆菌感染可能为胃癌治疗提供新策略。
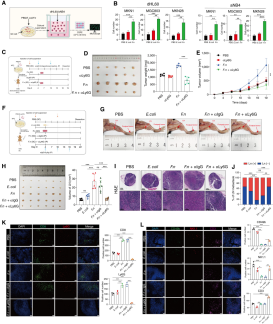
图5 具核梭杆菌介导的胃癌恶性进展与中性粒细胞募集显著相关
揭秘具核梭杆菌策反中性粒细胞的机制
研究者通过单细胞测序分析发现,具核梭杆菌感染的胃癌细胞通过激活IL17信号通路促进中性粒细胞招募和肿瘤相关中性粒细胞向促肿瘤表型极化。实验显示,活菌感染显著上调IL17通路活性及受体IL17RA表达,延长TAN寿命并促进其分化。临床数据表明,IL17A在胃癌组织中高表达且与不良预后相关。体内外实验证实,具核梭杆菌感染促进胃癌细胞分泌IL17A及IL1β、IL8等细胞因子,从而增强中性粒细胞招募。此外,菌感染通过IL17A调控cGAS–STING通路进而上调中性粒细胞PD-L1表达,抑制该通路可逆转这一效应。抗IL17A治疗在感染小鼠中显著抑制肿瘤生长、降低Ki67和中性粒细胞标志物Ly6G表达,且与中性粒细胞清除联用效果更显著,表明靶向IL17A策略在具核梭杆菌富集型胃癌中潜力突出。
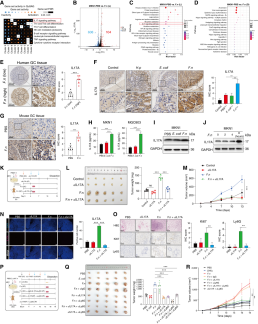
图6 具核梭杆菌激活胃癌细胞内IL17信号通路,介导TAN募集与分化
具核梭杆菌介导NF-κB/IL17通路串扰,招募中性粒细胞
NF-κB是调控炎症介质基因的关键因子。近年研究发现,具核梭杆菌可通过上调经典NF-κB通路,促进促炎细胞因子表达,从而引发结肠炎症和癌变。基因集富集分析显示,在具核梭杆菌感染的胃癌细胞中,NF-κB信号通路显著富集,表明该通路参与中性粒细胞活化及胃癌恶性进展。本研究认为NF-κB与IL17信号通路在肿瘤细胞—中性粒细胞相互作用中密切相关。
通过转录组差异基因分析与qRT-PCR实验,研究者发现RelB、TNFATP3、CXCL3等基因在NF-κB和IL17通路中均明显上调。Western blot结果显示胃癌细胞中p52和RelB蛋白水平显著升高,且RelB在具核梭杆菌处理组中表达增强,而在死菌组中无变化。免疫组化实验也显示,RelB在具核梭杆菌富集的人和小鼠胃癌组织中高表达,且与患者不良预后及中性粒细胞浸润正相关。
进一步实验表明,具核梭杆菌感染可促进Rel蛋白磷酸化及核转位。降低RelB表达后,中性粒细胞的趋化能力显著减弱。同时,RelB knockdown显著抑制了IL17A的分泌,而外源IL17A处理则提高了RelB蛋白水平。免疫荧光共定位显示,感染具核梭杆菌的小鼠肿瘤组织中RelB、IL17A及中性粒细胞标志蛋白Ly6G表达上升且空间分布一致。这些结果说明,RelB作为NF-κB/IL17通路中的关键靶基因,通过交叉互作增强了IL17A分泌,进而诱导中性粒细胞募集与分化,推动胃癌进展。
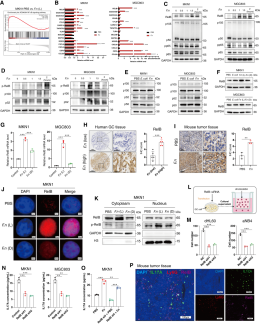
图7 具核梭杆菌激活IL17信号通路
具核梭杆菌助攻抗PD-L1治疗
为了探究中性粒细胞与其他免疫细胞的相互作用,研究团队采用CellPhoneDB进行分析。结果发现,在具核梭杆菌感染后,PD-L1阳性中性粒细胞与PD-1阳性T细胞之间的相互作用显著增强。该菌感染还导致肿瘤组织中PD-1表达明显上升,耗竭型CD8+ T细胞数量增多,提示中性粒细胞可能助推了T细胞功能耗竭。
进一步实验显示,清除中性粒细胞后,PD-1阳性CD8+ T细胞比例大幅下降,小鼠肿瘤体积也显著减小,说明中性粒细胞确实参与调控T细胞耗竭。而在小鼠模型中应用抗PD-L1治疗,具核梭杆菌感染组显示出更好的疗效,肿瘤体积显著缩小。但如果同时清除中性粒细胞,抗PD-L1治疗效果则会减弱。
临床样本分析表明,具核梭杆菌密度高的胃癌组织中CD66b阳性中性粒细胞增多,CD8+ T细胞富集;且该菌高丰度的患者对抗PD-L1治疗反应更佳,转移灶显著减少。这些结果提示,具核梭杆菌可能通过调节中性粒细胞,影响免疫微环境,进而提升免疫治疗敏感性。
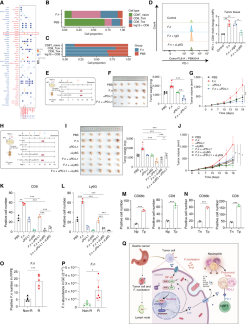
图8 具核梭杆菌介导TAN募集增强PD-L1阻断疗效
文献信息
Zhang T, Li Y, Zhai E, et al. Intratumoral Fusobacterium nucleatum Recruits Tumor-Associated Neutrophils to Promote Gastric Cancer Progression and Immune Evasion. Cancer Res. 2025;85(10):1819-1841. doi:10.1158/0008-5472.CAN-24-2580
 技术咨询:
技术咨询: