肠道菌群如何协同免疫治疗,重塑肿瘤微环境
2025-09-26
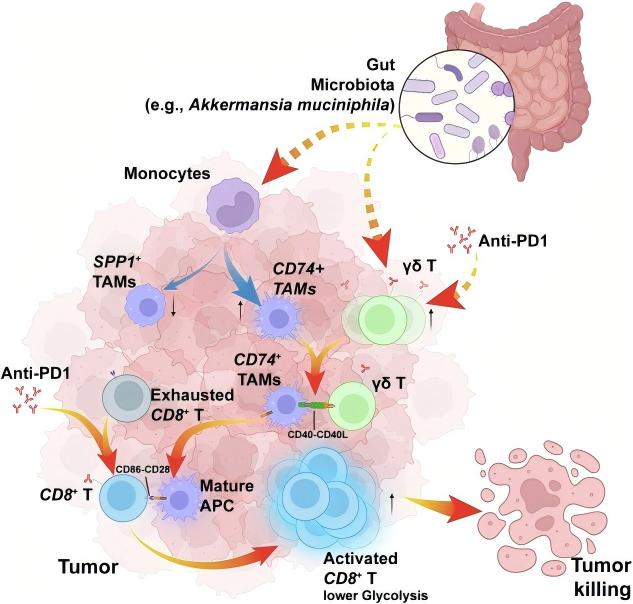
研究背景
免疫检查点抑制剂(ICI,如抗PD-1/PD-L1抗体、抗CTLA-4抗体)已在多种癌症治疗中取得突破性进展,但仅有15–40%的患者能从中长期获益。近年来研究表明,肠道菌群在调节ICI疗效中扮演关键角色。然而,肠道菌群如何通过调控肿瘤微环境(TME)影响ICI疗效,其具体细胞和分子机制尚不明确。文献通过单细胞RNA转录组测序(scRNA-seq)技术,结合多色免疫荧光、流式细胞术等功能实验,系统揭示了肠道菌群与ICI协同作用的细胞基础和信号通路。
单细胞层面揭示肠道菌群与ICI协同调控TME细胞组成
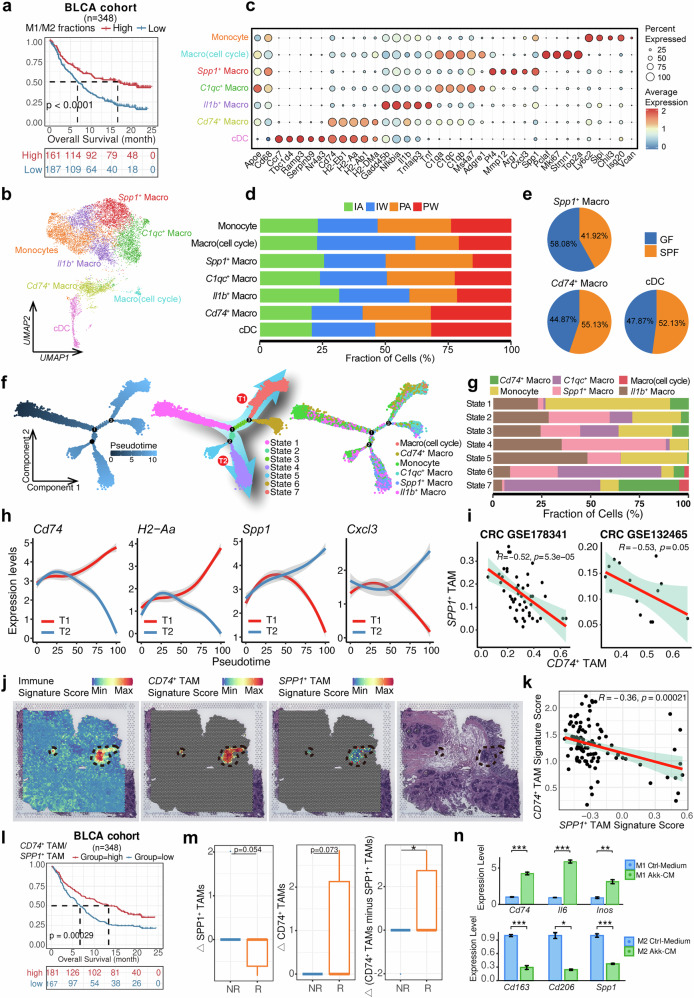
文献通过单细胞转录组测序技术深入探索了肠道菌群与免疫检查点抑制剂(ICI)在调控肿瘤微环境中的协同作用机制。研究人员建立了MC38小鼠肿瘤模型,并设计了四组实验条件:IgG联合抗生素(IA)组、IgG联合正常饮水(IW)组、抗PD-1联合抗生素(PA)组以及抗PD-1联合正常饮水(PW)组。实验结果显示,只有在PW组中观察到了显著的肿瘤生长抑制现象,这表明完整的肠道菌群是ICI发挥抗肿瘤疗效的必要条件。通过对scRNA-seq分析,研究人员鉴定出9种主要细胞类型,并发现PW组中T细胞显著增多,特别是CD8+和CD4+ T细胞亚群的比例明显上升,这提示肠道菌群对ICI治疗有促进作用,共同促进抗肿瘤免疫应答的建立。
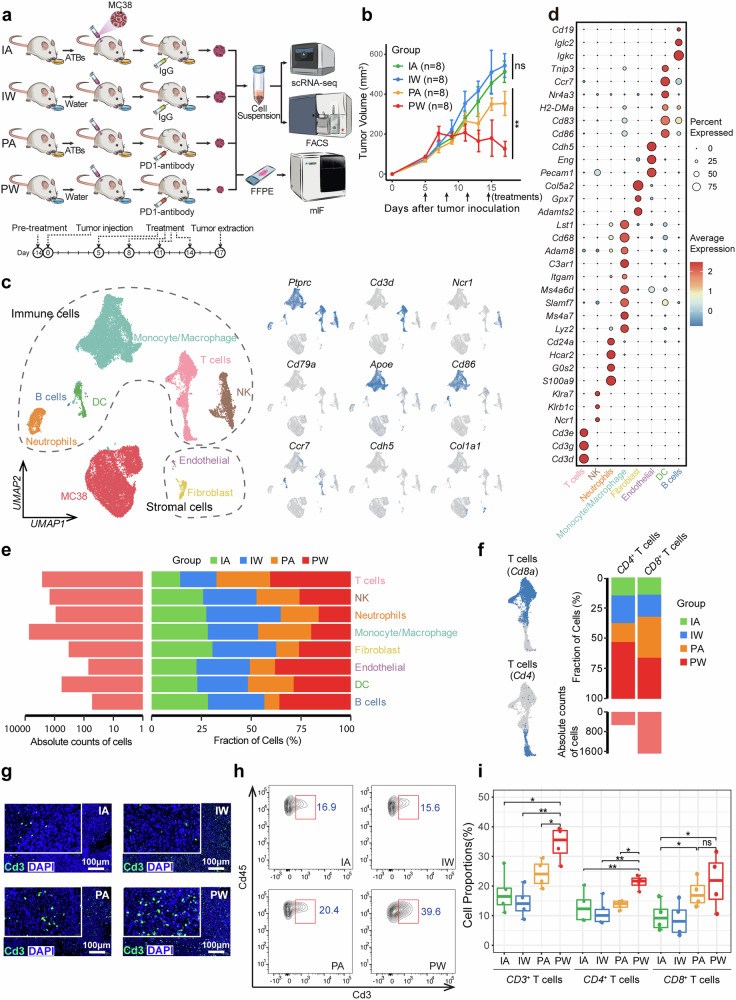
T细胞亚型分析揭示菌群影响T细胞功能状态
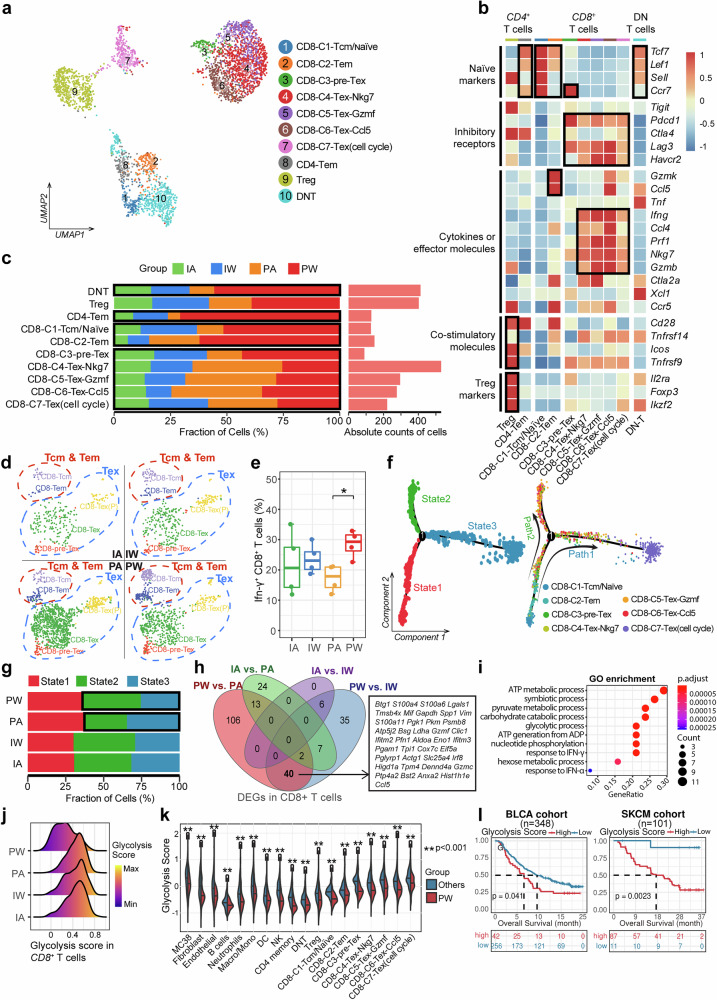
研究进一步对T细胞亚群的深入分析,揭示了肠道菌群在调节T细胞功能状态中的关键作用。研究人员将T细胞聚类划分为10个亚群,其中包括7个CD8+ T细胞亚型、2个CD4+ T细胞亚型以及1个双阴性T细胞(DNT)亚型。研究结果显示,在PW处理组中,中央记忆/效应记忆CD8+ T细胞(Tcm/Tem)的比例显著升高,而耗竭性CD8+ T细胞(Tex)的比例则明显降低。同时,该组中IFN-γ+ T细胞数量显著增多,且细胞的糖酵解水平明显下降,这表明肠道菌群可能通过调控细胞代谢重编程来增强T细胞的活性。通过拟时空分析,研究人员进一步发现PA组的T细胞更倾向于向终末耗竭状态分化,而PW组则更多地形成记忆/效应表型,这一发现强有力地证明了肠道菌群在维持T细胞功能活性方面发挥着重要作。
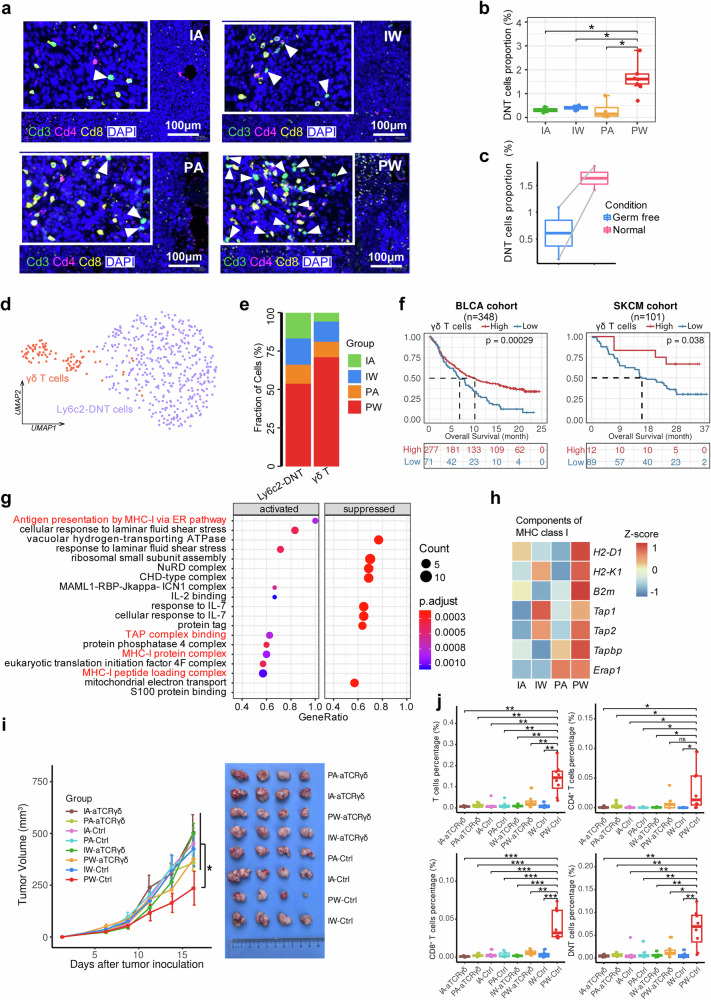
双阴性T细胞中γδ T细胞的关键作用
除了常规的αβ T细胞外,本研究还重点关注了双阴性T细胞(DNT)在菌群与ICI协同作用中的特殊贡献。研究数据显示,PW组中DNT的比例显著高于其他实验组,通过进一步的亚群分析发现这些DNT主要由Ly6C2-DNT和γδ T细胞两个亚群组成,其中γδ T细胞在PW组中表现出特别的富集现象。这些γδ T细胞数量增多,同时高表达MHC-I相关基因,提示它们可能具有抗原交叉提呈的功能。为了验证γδ T细胞的功能重要性,研究人员使用抗TCRγδ抗体特异性清除γδ T细胞后,观察到抗PD-1治疗的疗效显著降低,肿瘤内T细胞浸润明显减少,这充分证明了γδ T细胞在菌群与ICI协同作用中的重要性。
髓系细胞重编程从M2向M1表型转变
研究还深入探讨了肠道菌群与ICI联合治疗对髓系细胞的重编程影响。研究发现,PW组中的巨噬细胞和单核细胞表现出明显的向M1型极化的趋势,而PA组则倾向于M2型极化。通过单细胞分析技术,研究人员将髓系细胞划分为7个功能亚型,发现PW组中具有抗原提呈功能的Cd74+ TAM比例显著上升,而促瘤型的Spp1+ TAM比例则明显下降。轨迹分析结果显示这两种巨噬细胞亚型处于不同的发育路径,且表现出明显的负相关关系。同时,研究人员分析了临床样本数据,结果证实SPP1+ TAM与患者不良预后显著相关,而CD74+ TAM则与良好预后相关。这些发现揭示了肠道菌群通过调控髓系细胞分化状态来影响ICI疗效的机制,也为开发针对肿瘤相关巨噬细胞的治疗策略提供了新的方向。进一步的研究表明,这种髓系细胞重编程可能通过多种信号通路实现,包括NF-κB信号通路、JAK-STAT信号通路等,这些通路的激活状态直接影响巨噬细胞的功能特性和抗肿瘤活性。
SPP1+ TAM是菌群调控ICI疗效的关键靶点
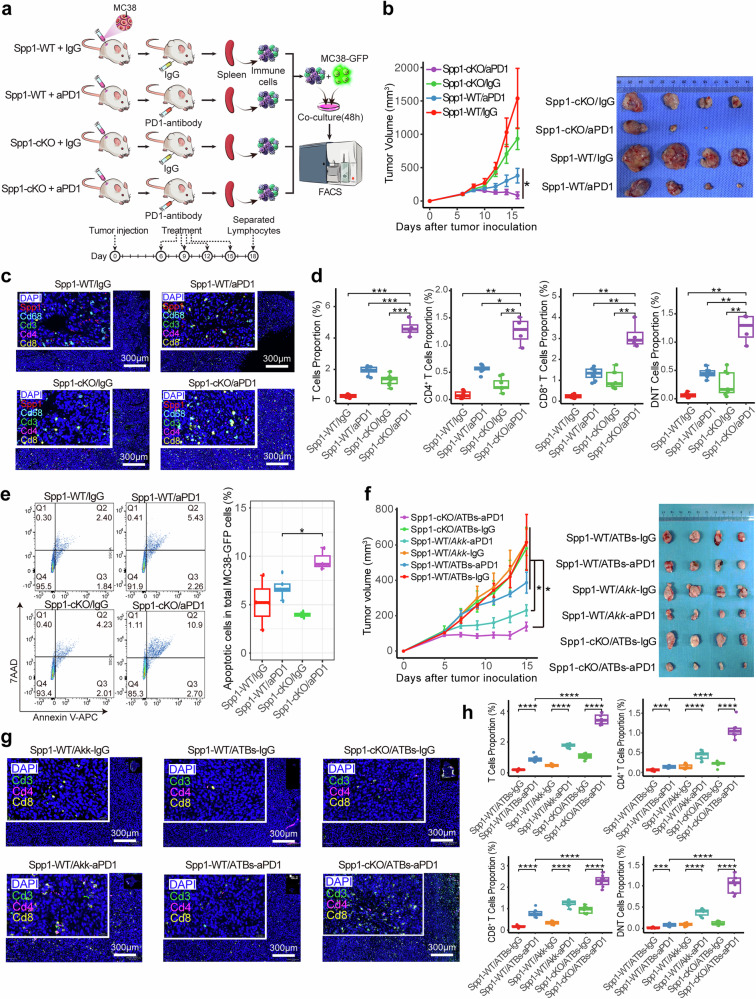
SPP1(骨桥蛋白)作为一种在多种癌症中与不良预后密切相关的因子,证实是肠道菌群调控ICI疗效的关键分子。研究人员发现,在PW组中Spp1基因表达水平显著降低,血清中骨桥蛋白浓度也相应下降。为了深入探究SPP1的功能作用,研究团队构建了髓系细胞特异性Spp1敲除小鼠(Spp1-cKO),实验结果显示即使在使用抗生素清除肠道菌群的条件下,Spp1-cKO小鼠仍然对抗PD-1治疗保持敏感,表现为肿瘤生长显著受限和T细胞浸润明显增加。
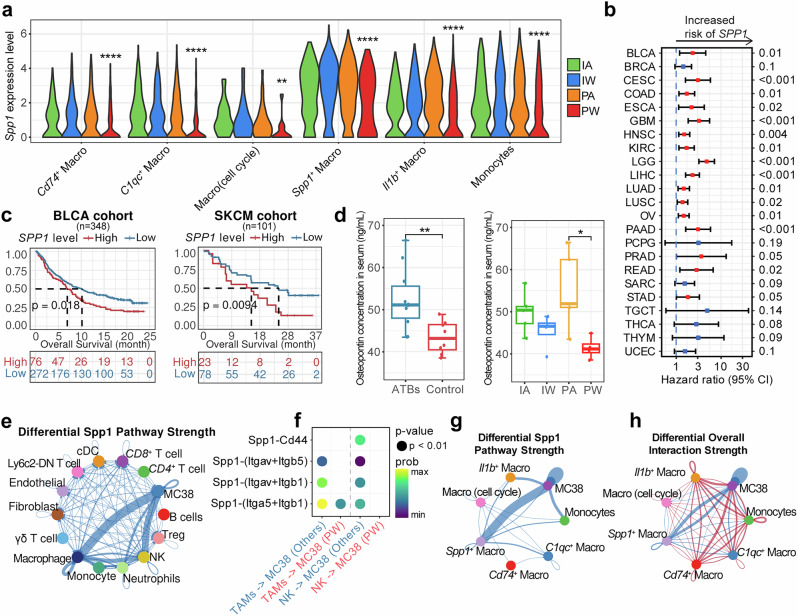
实验发现说明肠道菌群可能主要通过抑制Spp1+ TAM来增强ICI的治疗效果。进一步的机制研究表明,SPP1可能通过多种途径影响肿瘤微环境,包括促进血管生成、增强肿瘤细胞侵袭能力、抑制免疫细胞功能等。研究人员还发现,某些特定的肠道菌群代谢产物可能直接或间接地调控SPP1的表达,这为通过调控肠道菌群来改善ICI疗效提供了新的干预靶点。
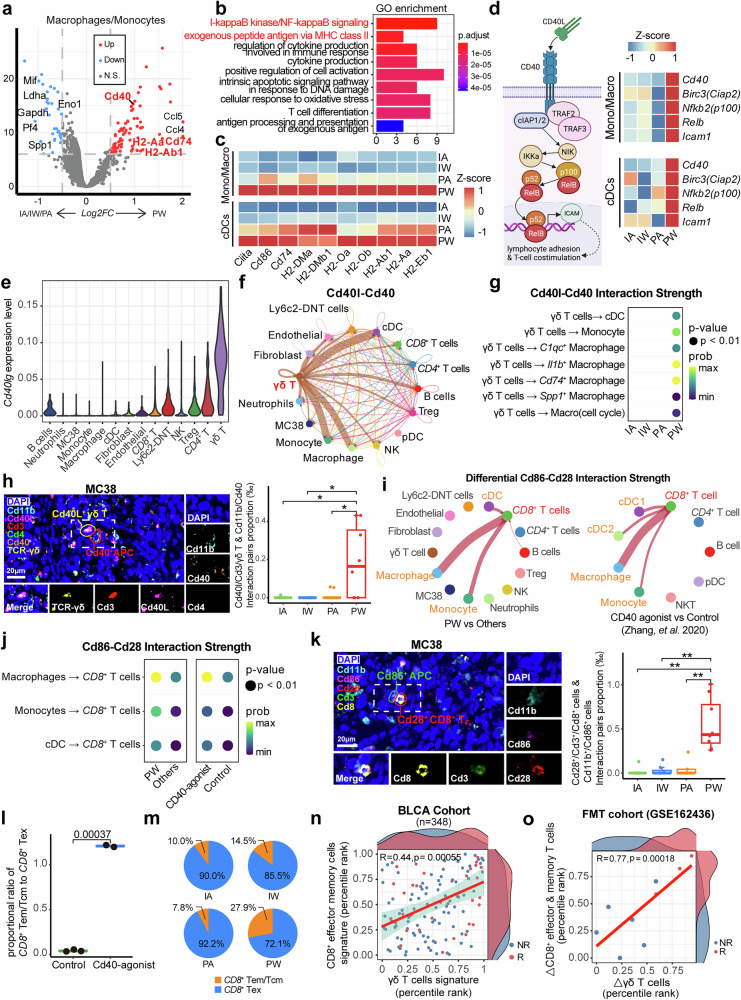
γδ T细胞-APC-CD8+ T细胞轴激活NF-κB通路
研究同时揭示了一条新的免疫激活通路:γδ T细胞-APC-CD8+ T细胞轴。在PW组中,抗原提呈细胞(包括Cd74+ TAM和树突状细胞)表现出高表达Cd40和MHC-II分子的特征,非经典NF-κB通路被显著激活。γδ T细胞高表达Cd40lg(CD40L),这些分子与APC上的Cd40结合后能够有效激活NF-κB信号通路,进而促进APC通过CD86-CD28共刺激信号激活CD8+ T细胞。通过多色免疫荧光实验,研究人员证实PW组中Cd40L+ γδ T细胞与Cd40+ APC的相互作用显著增多。为了验证这一通路的功能重要性,研究团队使用CD40激动剂进行处理,成功模拟了菌群与ICI的协同效应,显著提高了CD8+ T细胞中记忆/效应细胞的比例。这些发现不仅揭示了一条新的免疫调节通路,也为开发针对该通路的治疗策略提供了可能性。进一步的研究表明,这条通路可能受到多种因素的调控,包括肠道菌群的组成、菌群代谢产物的种类和浓度、以及宿主遗传背景等。
总结
文献通过多组学手段系统揭示了肠道菌群与ICI协同作用的细胞与分子机制,促进T细胞从耗竭向记忆/效应状态转变;驱动巨噬细胞从促瘤SPP1+ TAM向抗原提呈CD74+ TAM重编程;通过γδ T细胞–APC–CD8+ T细胞轴激活免疫应答。该研究不仅深化了对菌群-免疫互作的理解,也为临床联合菌群调控与免疫治疗提供了新策略,如靶向SPP1、使用CD40激动剂、补充特定益生菌等。
参考文献:Cao M, Deng Y, Hao Q, et al. Single-cell transcriptomic analysis reveals gut microbiota-immunotherapy synergy through modulating tumor microenvironment [J]. Signal Transduct Target Ther, 2025, 10(1): 140.
 技术咨询:
技术咨询: