组织驻留益生菌—肿瘤免疫治疗的新选择
2025-09-24

今天为大家介绍一种组织驻留菌中的益生菌-鼠李糖乳杆菌。鼠李糖乳杆菌从属于乳杆菌属,是人体益生菌之一,肠道黏着率高,定植能力强,可平衡和改善胃肠道功能、增强免疫力、预防和治疗腹泻、预防呼吸道感染、排除毒素、预防龋齿、预防过敏及抗癌等重要功能。
内蒙古大学张和平教授团队发表在EBioMedicine(IF=10.8)杂志上一篇名为Lacticaseibacillus rhamnosus Probio-M9 enhanced the antitumor response to anti-PD-1 therapy by modulating intestinal metabolites的文章中详细解析了该益生菌的抗肿瘤机制,为提高免疫治疗效果带来新可能,下面我们就来详细解析一下这篇文章。
文章链接:https://pmc.ncbi.nlm.nih.gov/articles/PMC10085781/
结果
Probiotic-M9的预防和治疗干预措施增强了抗PD-1的肿瘤抑制作用
为研究益生菌是否能够增强携带完整宿主肠道菌群的ICB的抗肿瘤效果,在注射CT26细胞前(Pre)或后(Post)给肿瘤小鼠喂食Probio-M9,并在肿瘤发展到可触摸时进行了抗PD-1治疗(图1A)。通过肿瘤体积和肿瘤重量初步评估肿瘤生长和抗肿瘤效果。由于肿瘤生长的抑制,无论是在预防还是治疗干预中,Probio-M9联合抗PD-1治疗均显著提高了携带肿瘤小鼠的生存率(图1B)。在第19天,Pre组的平均肿瘤大小最小,其次是Post组。在两组接受Probio-M9治疗的实验中,肿瘤体积和重量显著小于空白对照组(M组)和医学对照组(αPD-1组)(图1C和D)。与仅接受抗PD-1治疗的小鼠相比,Probio-M9的预防性干预在肿瘤生长的早期阶段(第10天)表现出显著的协同作用,而治疗性Probio-M9的联合抑制效应在灌胃后6天(第13天)显现出来(图1C)。这表明,Probio-M9的预防性和治疗性给药都可能更有利于协同促进抗PD-1的抗肿瘤免疫。
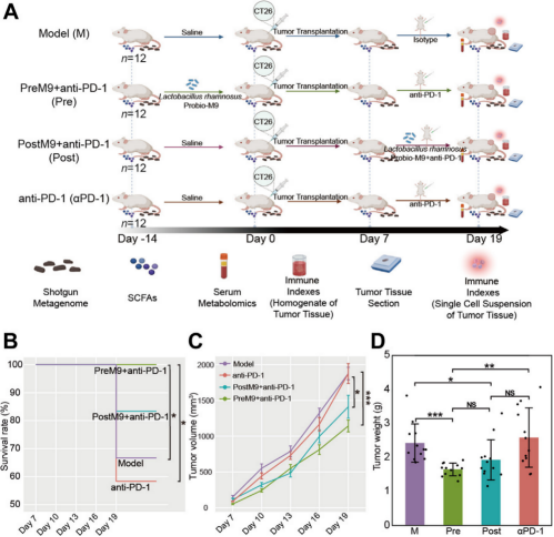
图1: Probio-M9与抗-PD-1联合的抗肿瘤效果
Probio-M9治疗与PD-1阻断的协同抗肿瘤效应与肿瘤微环境中的免疫力增加有关
除了肿瘤体积缩小外,Probio-M9和抗PD-1联合治疗还显著降低了小鼠移植瘤中Ki67的阳性率,这表明肿瘤细胞增殖被抑制(图2A和B)。接着通过研究是否有肿瘤浸润的T淋巴细胞增加时发现CD3的阳性率显著增加(图2C和D),同时接受Probio-M9治疗的小鼠肿瘤中CD8+和CD4+ T细胞的比例也显著增加(图2E和F)。值得注意的是,虽单独使用抗PD-1治疗的CD8+ T细胞比率比模型组更高,但联合使用Probio-M9进一步显著促进了这种免疫增强。此外,各组之间的IL-6浓度没有差异,但与另外两个非益生菌组相比,益生菌M9治疗组的IFN-γ表达增加,IL-10和FoxP3的表达显著减少(图2G-J)。这些结果表明,Probio-M9 可以通过促进CTLs和Th1细胞的浸润和活化,抑制调节性T细胞(Tregs)的功能,从而改善抗PD-1免疫治疗的效果。
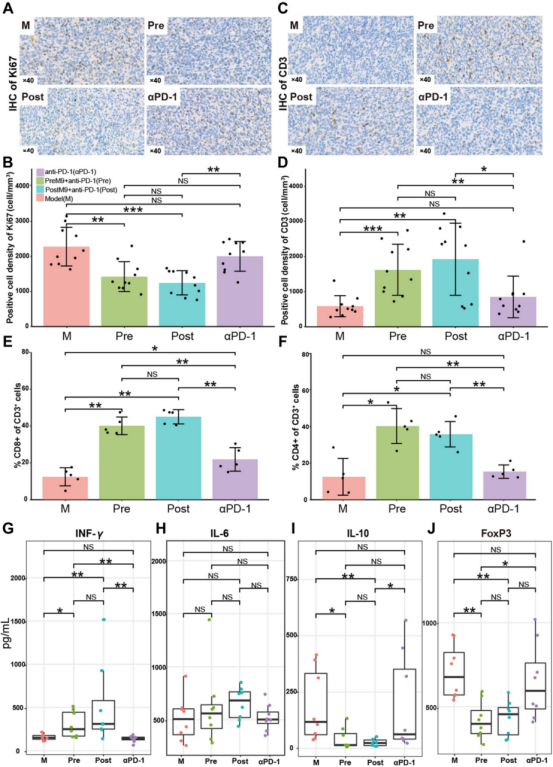
图2: Probio-M9和抗PD-1协同治疗增强抗肿瘤反应
Probio-M9通过增加共生有益菌来改善肠道菌群
为研究Probi-M9通过调节荷瘤小鼠的肠道菌群在抗PD-1治疗中的潜在作用进行了多时间点的宏基因组分析。发现Probi-M9灌胃显著影响了α和β多样性。在Pre和Post组中,益生菌干预后肠道菌群的丰富度显著增加(图3A)。在所有四个组中,物种结构组成在基线时相对聚集,而在Probi-M9治疗后,Pre组与其他组之间的Bray-Curtis距离显著增加(图3B)。这种动态变化随后通过每个组与初始菌群结构的Bray-Curtis距离差异体现(图3C)。表明Probio-M9治疗对肠道菌群的组成和结构产生了显著影响,这种效果在灌胃的早期阶段更为明显。
进一步分析每组菌群组成时间的变化。在属水平上,Lactobacillaceae的含量增加,而Bacteroides、Mucispirillum、Candidatus Arthromitus和Clostridium的含量在Probio-M9处理后减少(图3D)。Lactobacillaceae在调节肠道菌群和增强宿主免疫力方面发挥作用,而Mucispirillum可在宿主严重免疫缺陷时引起结肠炎,Candidatus Arthromitus与全身促炎因子水平升高相关。在种水平上,Probi-M9的干预增加了Lacticaseibacillus rhamnosus,Lactobacillus Johnsoii、Bifidobacterium animalis及其他对人类有益的细菌种类丰度(图3E)。
为找出肠道菌群与ICB疗效之间的关系,确定了对Probio-M9和抗PD-1联合治疗有响应的显著差异丰度种群。与两种非益生菌治疗组(M和αPD-1)相比,筛选出了与Probio-M9给干预(Pre和Post)相关的富集种群。Bifidobacterium animalis、Acinetobacter lwoffii、Staphylococcus lentus、Lactobacillus gasseri、Lactobacillus johnsonii和Lacticaseibacillus rhamnosus的丰度在Probio-M9治疗组中显著增加。此外,在增强免疫反应的组(Pre和Post)中,经过抗-PD-1治疗后鉴定出的增加物种包括Acinetobacter lwoffii、Aerococcus viridans、Bacillus isronensis、Bifidobacterium animalis、Enterococcus faecali、Enterococcus gallinarum、Lactobacillus gasseri、Lactobacillus johnsonii、Lactobacillus reuteri、Lactobacillus rhamnosu、Lysinibacillus unclassified和Staphylococcus lentus(图3F)。
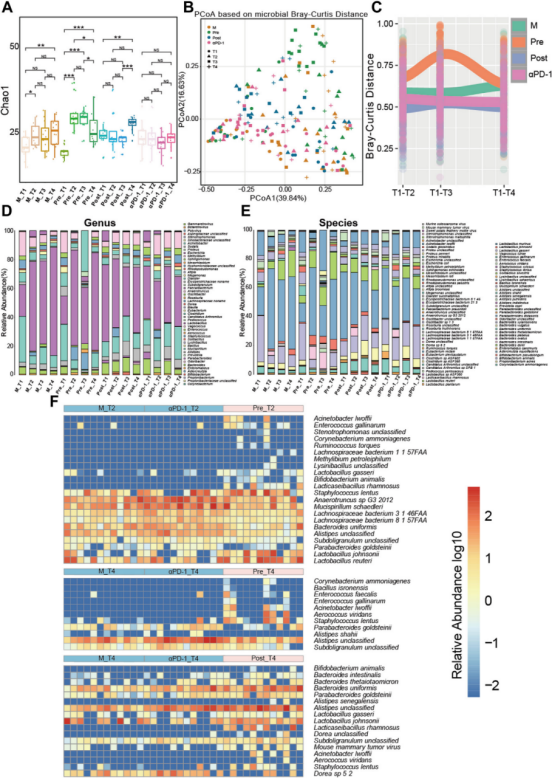
图3 通过Probio-M9给药和抗PD-1联合治疗对肿瘤小鼠肠道菌群的动态变化
Probio-M9通过上调特定的细菌种类和菌株来增加SCFAs的代谢
鉴于共生菌群通过表达特定代谢物常影响宿主生理,其中短链脂肪酸参与宿主免疫调节。对小鼠粪便中的乙酸、丙酸和丁酸进行了定性和定量鉴定,这些样本与代谢组测序样本平行。结果表明在Pre和Post组中,经过Probi-M9和抗PD-1联合治疗后,乙酸和丙酸的含量显著增加,而丁酸在Pre组中显著富集。相比之下,其他非益生菌治疗组中大多数SCFA没有显著变化(只有αPD-1组的丙酸含量显著增加(图4A),这表明Probio-M9灌胃可以增加小鼠体内的SCFA积累。随后在四个时间点对每组的肠道菌群和SCFA含量进行了Spearman相关性分析。结果显示,在非益生菌处理组(M和αPD-1)中,很少有细菌物种与SCFA相关,而在Probio-M9处理组(Pre和Post)中,正相关物种的数量增加。这些增加的物种包括Pre组中的Acinetobacter lwoffii、Aerococcus viridans、Staphylococcus lentus、Lactobacillus reuteri、Lactobacillus johnsonii、Enterococcus gallinarum、Lysinibacillus unclassified、Enterococcus faecali、Bacillus isronensis,Post组中的Acinetobacter lwoffii、Bifidobacterium animalis、Lactobacillus gasseri、Lactobacillus johnsonii、Lactobacillus rhamnosus(图4B)。这些结果表明,Probio-M9通过增加相关菌群种类来促进SCFA的产生。
此外,通过构建宏基因组组装基因组进一步鉴定种水平上与短链脂肪酸(SCFAs)相关的肠道菌群。系统发育树显示肠道菌群主要由Firmicutes构成,其他菌株则分布于Bacteroidota、Proteobacteria、Deferribacterota、Desulfobacterota、Actinobacteriota和Cyanobacteria(图4C)。与先前种水平相关性研究结果一致,在两个Probio-M9干预组中,与SCFAs正相关的菌株数量均高于α-PD-1组(图4D)。针对在种水平和菌株水平均与SCFAs含量显著正相关的细菌进行了深入筛选,其中预防组特异性增加的菌株有8株,包括Lactobacillus reuteri、 Lactobacillus murinus、Lactobacillus johnsonii、Staphylococcus lentus、Enterococcus gallinarum、Eubacterium plexicaudatum、Eubacterium plexicaudatum和Lysinibacillus sp.(图4E)。可推测Probio-M9的预防干预可能通过富集更多产短链脂肪酸菌株,这可能是该组在后续抗肿瘤免疫治疗中效果更佳的原因。
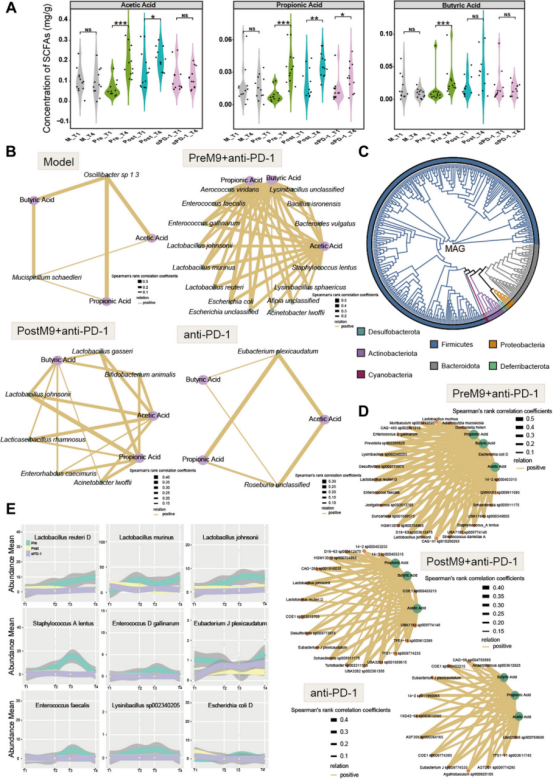
图4 益生菌M9显著增加了菌群产生的SCFA与特定菌种或菌株的相关性
Probio-M9与肿瘤携带小鼠免疫之间的相互作用基于代谢调节
为探究有或没有Probio-M9治疗的肿瘤小鼠肠道环境和宿主免疫的差异是否存在联系,基于代谢组策略进行了血清代谢物的检测。共注释了1643种化合物,并根据是否使用抗PD-1或Probio-M9筛选出208种差异表达的代谢物(DEMs),这些差异表达模块(DEMs)可以富集在一些功能通路中,如嘌呤代谢、烟酸和烟酰胺代谢、精氨酸生物合成、缝隙连接、昼夜节律调节、醛固酮合成和分泌以及C5-分支二羧酸代谢。根据Spearman相关性分析,27个DEMs与肿瘤体积显著正相关,而另外23个DEMs与肿瘤体积显著负相关(图5A)。由Probio-M9上调且与肿瘤生长呈负相关的功能性代谢物,以及由Probio-M9下调且与肿瘤生长呈正相关的代谢物,可以被认为是代谢生物标志物的候选者,包括鸟苷、α-酮戊二酸、6-羟基-3-琥珀酰吡啶、N-乙酰-左-谷氨酸、吡哆醇、多巴醌、黄嘌呤、醛固酮、L-苏-3-甲基天冬氨酸、3′-烯酸、腺苷5′-二磷酸、毒毛花苷和倍半萜二磷酸(图5B)。该结果表明Probio-M9可能调节小鼠血清中某些代谢物的变化,这些代谢物与肿瘤抑制相关。
进一步从Probio-M9上调的菌群、SCFAs、小鼠代谢物和抗肿瘤免疫之间的总体相关性,对肠道环境和宿主免疫之间的潜在关系进行了解释。结果表明,SCFAs通过血清代谢物与Ki67呈负相关,与CD3呈正相关,而SCFAs的这种相关性又与Probio-M9上调的菌群种类有关(图5C)。因此推断Probio-M9与抗PD-1联合使用以改善ICB抗肿瘤反应的机制。Probio-M9通过增加益生菌来调节肿瘤小鼠的肠道菌群,从而促进乙酸、丙酸和丁酸在肠道中的积累。这些产生SCFA的细菌进一步增加了小鼠血循环中的特定代谢物,包括α-KG、N-乙酰-L-谷氨酸和吡哆醇,这促进了CTLs在肿瘤微环境中的浸润和活化,并抑制了Tregs的功能(图5D)。
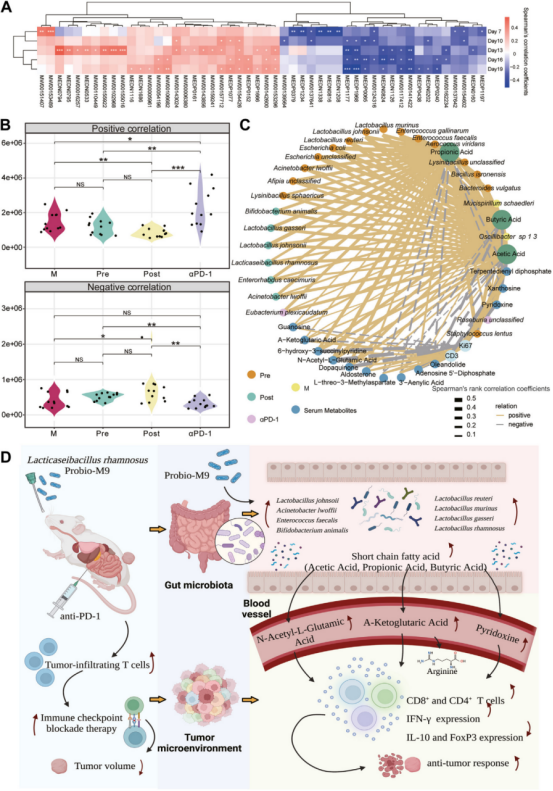
图5 益生菌-M9和抗-PD-1通过菌群衍生和宿主代谢物的交叉对话的协同抗肿瘤作用机制
Probi-M9在增强抗PD-1方面的有益效果可通过粪便菌群移植或粪便上清移植传递
为了直接确认Probio-M9在抗PD-1中的协同机制是否通过调节肠道菌群介导而进行粪便移植,包括来自Pre组小鼠的FMT和FST移植,这些小鼠在ICB治疗下表现出了最佳效果,移植到另外两组小鼠中,一组接受粪便菌群(FMT + αPD-1组),另一组接受粪便上清液(FST+αPD-1组),并在肿瘤植入后进行抗PD-1治疗(图6A)。两组受体小鼠的抗肿瘤效果显著改善,带瘤小鼠的生存率增加,肿瘤生长被抑制(图6B–D)。
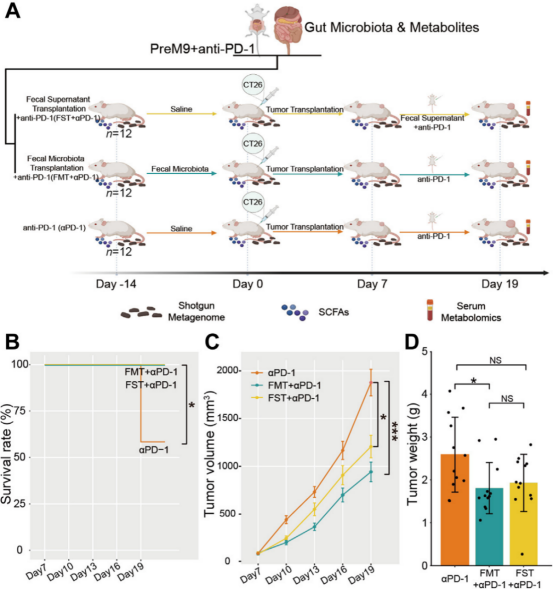
图6 粪菌移植传递的抗肿瘤效果
对供体和受体小鼠的粪便进行了宏基因组分析。乳杆菌种类如Lactobacillus murinus、Lactobacillus reuteri和Lactobacillus johnsonii包含在供体粪便中(图7A)。在这些粪便移植到受体小鼠后,FMT + αPD-1组的样本随着时间的推移变得与Pre组相似。相比之下,仅接受粪便上清移植(FST + αPD-1组)的小鼠粪便与供体分离(图7B). 进一步分析发现,在11种既被Probi-M9显著上调又与SCFAs在发现队列中显著相关的细菌物种中,有6种在验证队列中由于FMT或FST而增加,包括Lactobacillus johnsonii、Lactobacillus murinus、Acinetobacter lwoffii、Lactobacillus reuteri、Aerococcus viridans和Lactobacillus gasseri(图7C)。然后根据粪便SCFAs的分析,移植菌群或上清液后,乙酸、丙酸和丁酸的含量显著增加 (图7D)。最后,基于血清代谢组分析,FMT或FST治疗的小鼠中α-KG的丰度显著增加(图7E)。尽管粪便上清液没有显著改变受体小鼠的群落多样性,但仍然可以得到与Probio-M9干预相似的结果。
综上,受体小鼠在菌群、代谢和抗肿瘤功效方面基本重现了供体小鼠的观察结果。这些结果进一步验证了辅助益生菌在肿瘤免疫治疗中的协同机制及其因果作用。可得出结论,Probio-M9通过调节肠道菌群、增加有益代谢物(如短链脂肪酸和氨基酸)以及重新编程宿主代谢物,可以改善对anti-PD-1的反应。
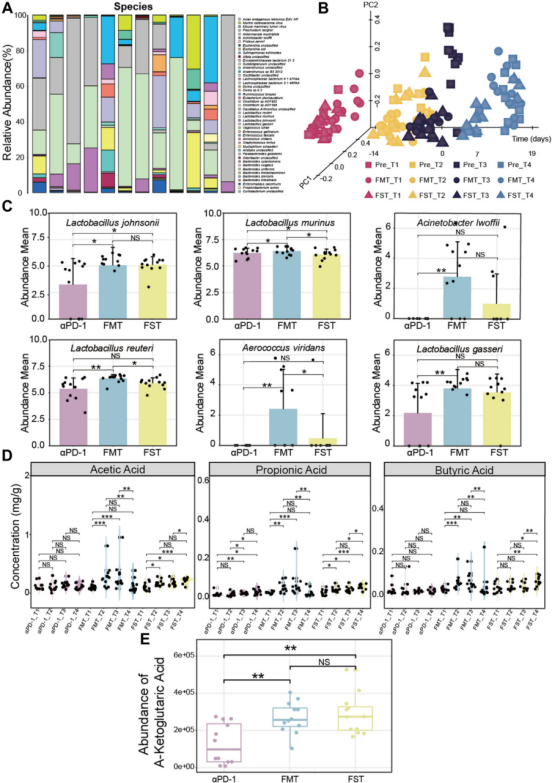
图7 粪菌移植小鼠肠道菌群和代谢产物的再现性
总结
该研究揭示了益生菌鼠李糖乳杆菌Probio-M9通过调节肠道菌群及其代谢产物,增强抗PD-1免疫疗法疗效的双重机制。一方面,Probio-M9重塑肠道微生态,增加有益菌和SCFAs的产生;另一方面,SCFAs促进免疫调节分子在血清的积累,后者通过表观遗传修饰促进效应T细胞分化和浸润,同时抑制Treg细胞,从而优化肿瘤微环境,增强免疫反应。粪便移植实验进一步证实菌群及其代谢物的因果关系。
通过对益生菌调节肠道代谢物增强抗肿瘤反应的机制研究,极大地深化我们对“益生菌-肠道菌群-宿主免疫”三者关系的理解。为未来基于特定菌株、合理设计针对性菌群干预策略奠定坚实的科学基础,并有效提升癌症免疫治疗的疗效并推动临床癌症治疗的发展。
 技术咨询:
技术咨询: