【文献分享】肿瘤源性促红细胞生成素在癌症免疫中作为免疫抑制开关
2025-09-23
题目:Tumor-derived erythropoietin acts as an immunosuppressive switch in cancer immunity
肿瘤源性促红细胞生成素在癌症免疫中作为免疫抑制开关
期刊:Science
作者信息:美国斯坦福大学David Kung-Chun Chiu、Edgar G. Engleman研究团队
发表时间:2025年4月25日
文章链接:https://www.science.org/doi/10.1126/science.adr3026
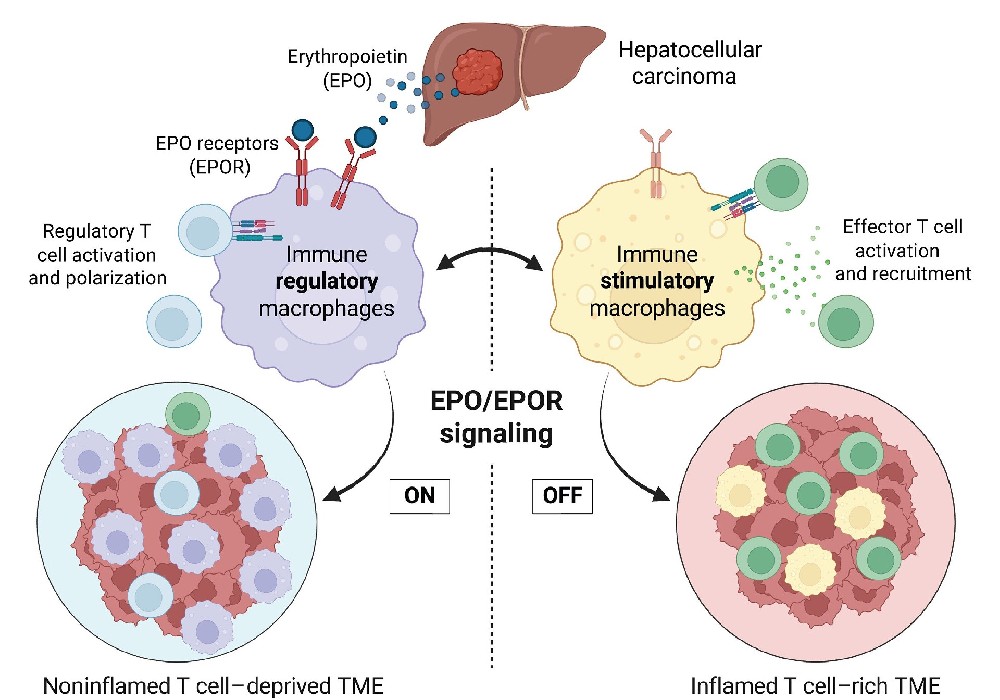
“炎症型”(富含T细胞)肿瘤特征的癌症患者通常能从免疫检查点阻断(ICB)疗法有良好反应,然而临床中多数患者表现为“非炎症型”(T细胞缺乏)肿瘤,这类患者仍对ICB治疗无响应。尽管许多肿瘤具有高突变负荷这一理论上应能触发免疫应答的特征,却仍表现为免疫排斥。目前,决定肿瘤免疫细胞特征(免疫分型)的内在机制尚未明确。这篇文章揭示了肿瘤细胞分泌的促红细胞生成素(EPO)在癌症免疫中作为免疫抑制开关,在决定肿瘤免疫表型中起着关键作用。
研究结果
1.肿瘤EPO决定肿瘤免疫微环境类型
为探究肿瘤免疫逃逸机制,作者开发了一系列自发性肿瘤模型,每个模型都有一个明确的炎症或非炎症肿瘤微环境(TME)。通过建立自发性肝细胞癌(HCC)小鼠模型,Trp 53 KO和PtenKO肿瘤表现出与“非炎症”肿瘤相关的特征,这些肿瘤中观察到脾肿大和血浆促红细胞生成素(EPO)升高,HGB、HCT和RBC增加,反映了EPO的红细胞生成作用(图1A-D)。对来自TCGA和ICGC数据库的人HCC样品的分析揭示,肿瘤中EPO表达升高与生存率下降、大血管浸润等相关(图1 E)。分析显示过表达与肝细胞癌TME内调节性T细胞和M0静息巨噬细胞的频率较高相关(图1F)。EPO不表达后肿瘤体积显著减少,CD8+ T细胞显著增加,中性粒细胞和单核细胞显著减少(图1G-I),表明EPO在促进HCC非炎症性肿瘤发展中起着关键作用。在Hepa1-6原位模型中,EPO过表达使本应消退的肿瘤持续生长,导致TME从T细胞富集转为髓系细胞富集(图1J-K),CD8+T细胞减少而CD4+T细胞增加(图1L-M),T细胞耗竭可逆转此效应(图1N)。这些结果证实EPO通过重塑TME免疫组成促进免疫逃逸。这些数据表明EPO在TME内自主塑造免疫室,从而逃避T细胞介导的肿瘤攻击。
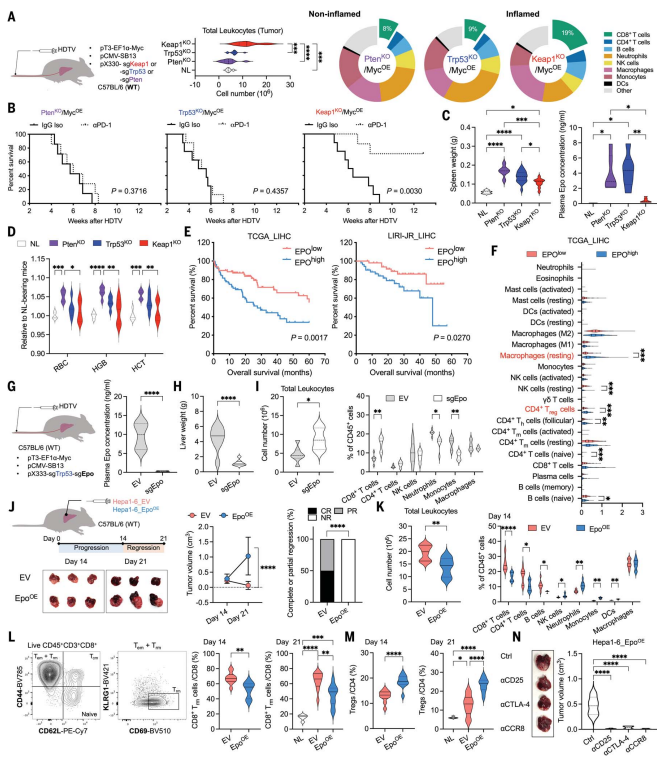
图1 肿瘤分泌的EPO自主建立非炎症肿瘤微环境
2.免疫调节性巨噬细胞是人和小鼠HCC中的主要EPOR+群体
肿瘤浸润的EPOR+白细胞主要由巨噬细胞组成,包括三个不同的亚群:CD 11bhi MDMs、CD 11blo MDMs和TIM-4+(KCs)巨噬细胞(图2A),CD 11blo MDMs和KCs表现出较高的EPOR表达,较低的MHCII表达(图2B)。EPO促进TIM-4+ KC扩增并下调其MHCII表达(图2C-D),在Ms4a3-EGFP小鼠中EGFP+ KCs比例增加(图2E)。
人HCC组织中,EPOR+细胞主要是CD11b+ CD68+巨噬细胞,肿瘤组织(T)中EPOR表达高于癌旁(NT)(图2F-H)。EPO mRNA的过表达也与人HCC中较高的EPOR mRNA水平相关(图2I)。人肝脏scRNA-seq显示EPOR+巨噬细胞与非炎性KC样细胞特征正相关,且MHCII表达较低,EPOR+巨噬细胞富集KC相关功能基因,EPOR+巨噬细胞显示与LILRB5+代谢和免疫调节KC的相关性最高(图2J-K)。与小鼠一致,高表达EPOR的巨噬细胞通常呈现较低的MHCII表达,且EPO会下调MHCII的表达。这些发现表明EPOR+巨噬细胞是HCC中主要的EPOR+群体,具有免疫调节KC特征。
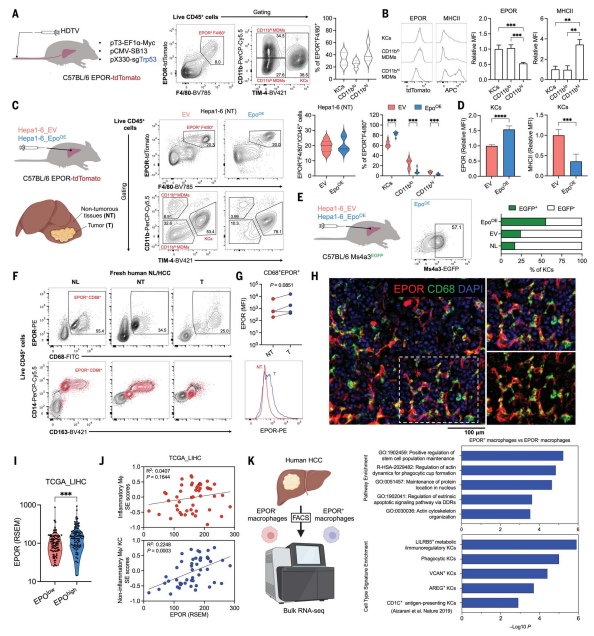
图2 Kupffer细胞和单核细胞来源的巨噬细胞是肝细胞癌中占主导地位的EPOR+群体
3.EPO激活EPOR+巨噬细胞驱动非炎症肿瘤免疫型,靶向EPO受体导致肿瘤消退
为了验证“EPOR+巨噬细胞直接介导EPO的作用,并且对于防止HCC中的免疫监视是必不可少的”这一假设,建立Epor−/−小鼠(Epor△LysM),巨噬细胞中EPOR的缺失对非炎症肿瘤的小鼠的存活率有显著改善(图3A)。通过生物发光成像监测肿瘤生长动力学,发现Epor△LysM小鼠表现出振荡模式(图3B),表明在没有EPOR+巨噬细胞的情况下,肿瘤确实发生了,但可能受到了主动免疫监视。Keap1KO肿瘤也表现出振荡模式,尽管与非炎症肿瘤相比,分泌的EPO水平显著较低,补充EPO后加速了Keap1KO肿瘤的生长,导致与非炎症肿瘤相似的线性生长动力学(图3C)。Epor△LysM小鼠中的Epo分泌肿瘤和WT小鼠中的EpoKO肿瘤都不能逃脱免疫监视(图3D)。在巨噬细胞缺乏EPOR的原位HCC模型中,EPO过表达的Hepa 1 -6肿瘤未能逃避T细胞监视并消退(图3E)。因此,EPO激活巨噬细胞上的EPOR不仅是非炎症免疫抑制肿瘤发展所必需的,而且去除任何一种都会导致炎症肿瘤,而与肿瘤基因型无关。为了确定在肿瘤建立后抑制EPOR表达是否导致肿瘤消退,通过干扰来降低巨噬细胞中EPOR的表达,EPOR减弱时,肿瘤消退(图3 F-G)。这些数据表明,非炎症性HCC依赖于EPO的产生来逃避免疫监视,巨噬细胞EPO/EPOR轴是主要的免疫抑制机制。
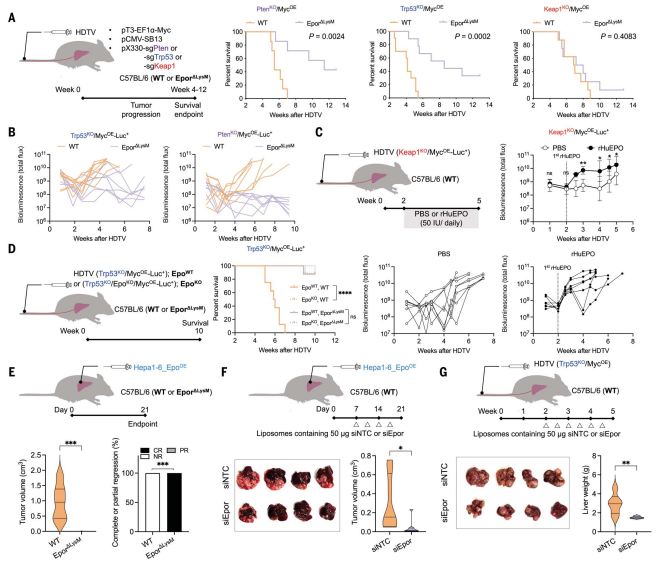
图3 去除巨噬细胞中的EPOR可促进抗肿瘤免疫并导致肿瘤消退
4.巨噬细胞中EPOR的消退引起T细胞介导的抗肿瘤免疫应答,与抗PD-1免疫疗法协同作用
在Trp53 KO肿瘤中,敲除巨噬细胞中的EPOR导致白细胞浸润以及效应T细胞/巨噬细胞显著增加,MHCII表达升高(图4A),支持EPOR+巨噬细胞维持免疫抑制性TME的假说。CD8+ T细胞耗竭实验证实该抗肿瘤免疫具有T细胞依赖性(图4B)。高维光谱流式细胞术来分析显示Epor△LysM小鼠中的急剧亚群移位(图4C)。巨噬细胞中EPOR的消退导致早期活化和产生肿瘤坏死因子(TNFα)的CD 8 + TEM细胞亚群扩增(图4D)。这些结果表明,EPOR在巨噬细胞中充当免疫抑制开关,并且触发EPOR信号传导阻止巨噬细胞激活肿瘤杀伤CD8+ T细胞。在不响应抗PD-1单一疗法的Trp 53 KO模型中,巨噬细胞中EPOR的消除和抗PD-1的组合导致显著的协同抗肿瘤作用,在所有小鼠中肿瘤完全消退(图4E)。在已形成的非炎症性肿瘤中使用他莫昔芬诱导的巨噬细胞EPOR缺失或使用EPOR-Fc嵌合蛋白中和EPO(图4 F-G),均能有效阻断EPO/EPOR信号通路并抑制肿瘤生长。总之,巨噬细胞中的EPO/EPOR信号转导会抑制T细胞活化,并在非炎症肿瘤TME中起关键作用,而靶向这一通路可以将非炎症性HCC转化为T细胞炎症性和免疫治疗应答性HCC。
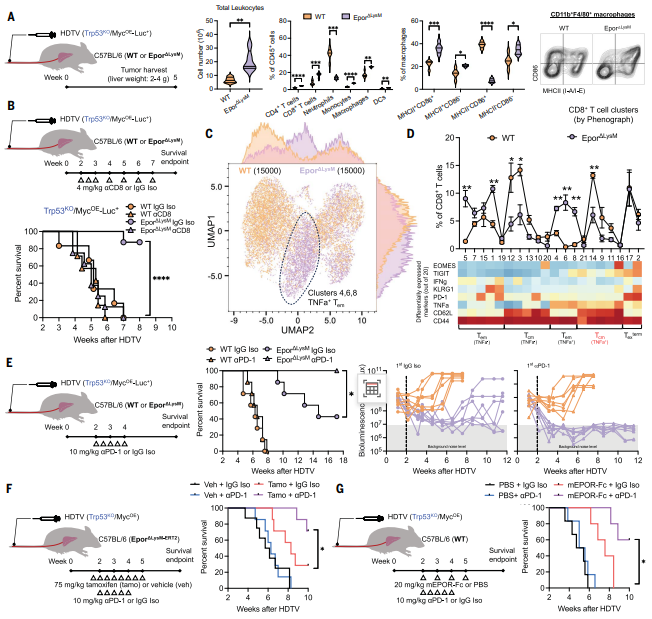
图4 去除巨噬细胞中的EPOR可促进T细胞活化,增强对抗PD-1免疫疗法的反应
5.EPO通过EPOR将巨噬细胞转化为免疫调节细胞
研究结果表明,EPO通过EPOR重编程巨噬细胞,促进免疫抑制并抑制抗肿瘤T细胞免疫。在HCC模型中,EPO刺激导致肝巨噬细胞(KCs)中炎症和抗原呈递相关蛋白(如MHCII、TNFα和IL-1β)表达下调,同时上调调节性蛋白(CD31、MERTK和CD206)(图5A)。RNA-seq分析发现(图5 B-E),EPO/EPOR信号在KCs中诱导了独特的转录组特征:与KCEV相比,KCEpo中有593个基因上调、319个基因下调。上调基因主要涉及清道夫受体介导的配体结合、组蛋白三甲基化和铁代谢等功能;而下调基因则与抗原呈递、炎症反应和细胞活化相关。这些变化在单核细胞来源的巨噬细胞(MDMs)中同样存在,且可通过敲除EPOR消除,证实了EPO/EPOR信号轴在不同巨噬细胞群体中的保守调控作用。研究表明人类肝癌中的巨噬细胞同样受EPO调控,EPO/EPOR信号轴在人HCC中调控肝巨噬细胞功能,并可能促进免疫调节性KC亚群的扩增,这与小鼠中的发现一致(图5G)。为了进一步研究免疫调节的EPO/EPOR途径的下游介质,使用GSEA鉴定了在人ILIRB5+ KC的KCEpo中关键富集的34个基因(图5H)。ChIP-X富集分析表明,控制造血和干细胞生物学的一般转录因子可以调节这些基因(图5I)。
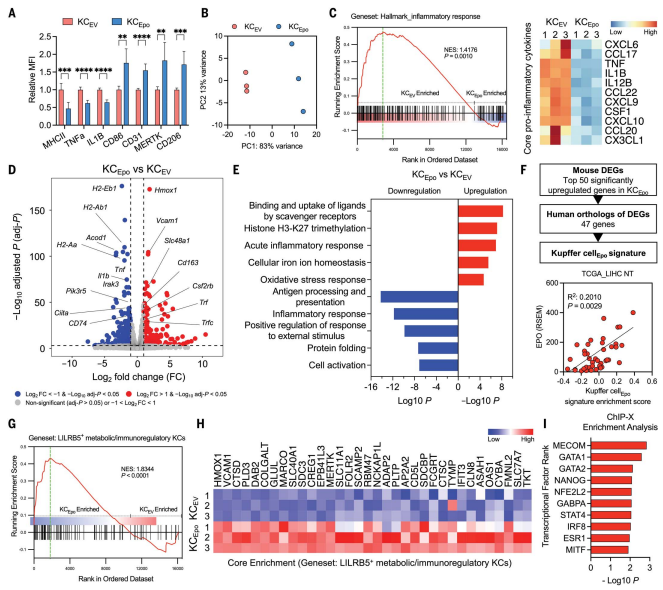
图5 Kupffer细胞和单核细胞衍生的巨噬细胞在EPO/EPOR轴激活后产生调节表型
6.NRF2是巨噬细胞中EPO/EPOR轴的关键下游介质
EPO刺激诱导NRF2在HCC小鼠的KC中的核定位(图6A),显著上调巨噬细胞内HMOX1等铁代谢相关基因(图6B-D)。这些基因中的大多数是NRF2调节靶点,并且EPO/EPOR信号传导的缺失导致其表达水平显著降低(图6E)。因此,推测EPOR的激活通过调节NRF2诱导肝巨噬细胞中血红素耗竭和抗氧化。与假设一致,EPO刺激降低了Hepa 1 -6原位模型以及人MDM中KC中的血红素水平(图6F)。此外,EPOR缺失增加了Trp53 KO和PtenKO非炎症HCC模型中肿瘤内巨噬细胞中的细胞内血红素水平(图6G)。在野生型小鼠中,EPO过表达肿瘤能够逃避免疫监视,而在髓系特异性Nrf2敲除(Nrf2ΔLysM)小鼠中,肿瘤生长显著减缓(图6J-K),并伴随CD8+T细胞浸润增加(图6H-I)。这些发现证实EPO/EPOR通过NRF2介导的血红素代谢重编程,赋予巨噬细胞免疫抑制特性,进而促进HCC免疫逃逸。
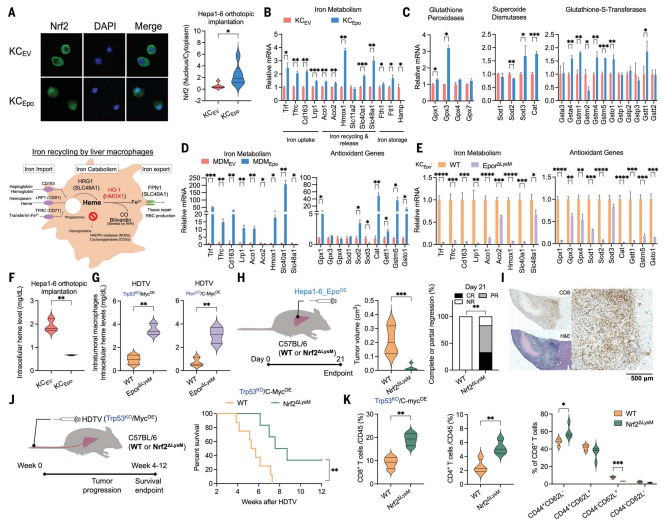
图6 NRF2激活和血红素消耗对EPO介导的免疫抑制至关重要
这篇文献聚焦肿瘤免疫,通过构建多种自发肝细胞癌小鼠模型,发现肿瘤分泌的促红细胞生成素(EPO)与肿瘤相关巨噬细胞上的EPO受体(EPOR)结合,阻止其分化为具有免疫刺激功能的巨噬细胞,这类细胞本可驱动效应T细胞(绿色标记)的活化与募集。相反,经EPO刺激的巨噬细胞呈现免疫调节特性:既能促进调节性T细胞(蓝色标记)的活化,又能维持肿瘤微环境(TME)处于低炎症状态且缺乏T细胞浸润。靶向巨噬细胞中的EPO/EPOR信号轴,可将这种非炎症性的肿瘤微环境转变为免疫活跃的炎症状态。
 技术咨询:
技术咨询: