【文献分享】中药八味败毒散通过调控肠道菌群和巨噬细胞缓解脓毒症肝损伤
2025-12-25

研究背景:
脓毒症引起的肝损伤(SILI)是导致脓毒症患者死亡的关键因素之一。抗生素是脓毒症初始治疗的核心手段,但其不当使用可能引发多重耐药性感染甚至死亡,因此亟需探索新的靶向治疗策略。近年来,肠-肝轴(肠道与肝脏通过微生物、代谢和免疫相互作用形成的双向通路)被证实是脓毒症中器官间交流的重要桥梁。研究表明,肠道菌群失调会破坏肠道屏障功能,加剧免疫紊乱和肝损伤,而调控肠道微生态已成为肝损伤防治的新方向。八味败毒散(BWBDS)作为由人参、百合、黄精、金银花、沙棘、杏仁、桔梗和柏皮组成的中药复方,临床已用于术后抗感染治疗。本研究通过网络药理学预测其作用机制,并采用盲肠结扎穿刺(CLP)模型模拟脓毒症,结合粪便菌群移植(FMT)、16S rRNA PacBio SMRT测序等技术,验证肠道菌群在其中的作用。进一步通过氯膦酸盐脂质体清除巨噬细胞及抗IL-10受体抗体,深入探讨了肠道菌群调控脓毒症肝损伤的机制。
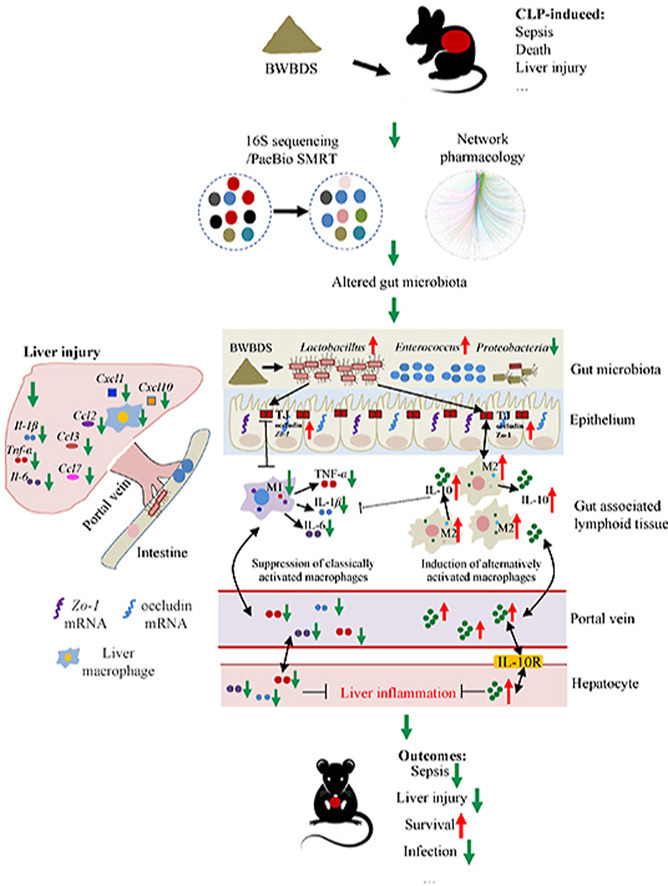
研究结果
1.BWBDS显著改善脓毒症肝损伤
在盲肠结扎和穿刺术(CLP)小鼠手术前两周给予BWBDS处理的小鼠存活率显著提高(图1A),临床评分明显降低。检测小鼠血清中细胞因子的分泌发现,BWBDS治疗显著降低了促炎细胞因子IL-6、IL-1β和TNF-α的水平,同时上调了抗炎细胞因子IL-10的表达(图1B)。组织学分析表明,BWBDS处理的小鼠肝脏的病理变化较少(图1C和D)。血清转氨酶水平表明,术后24小时,BWBDS处理的小鼠的ALT和AST明显低于CLP对照组小鼠 (图1F和G)。
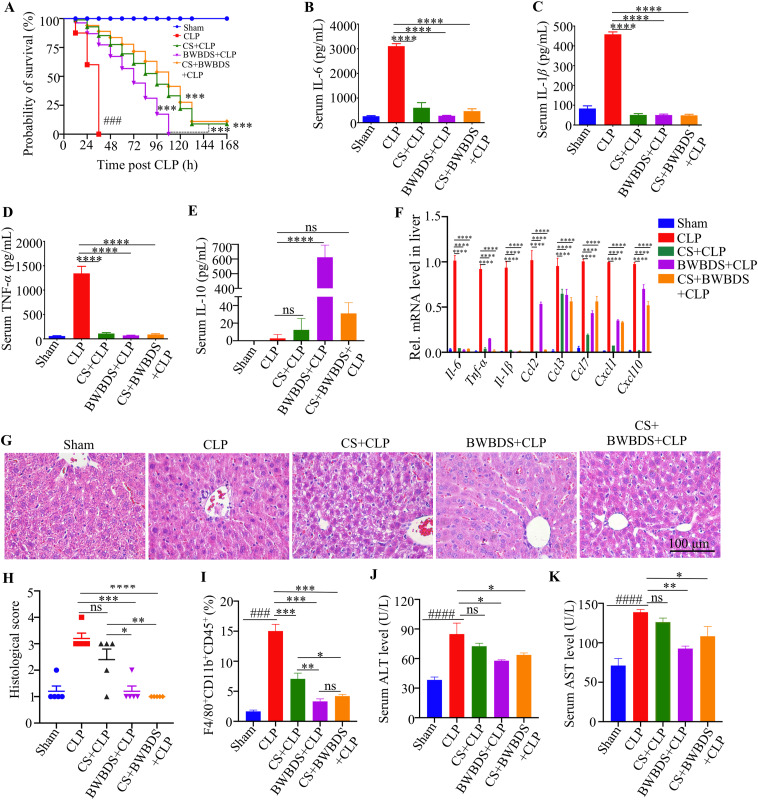
图1.八味败毒散(BWBDS)单独治疗可保护小鼠免受败血症性肝损伤(SILI)
2. BWBDS调节巨噬细胞极化
检测脾脏、腹膜巨噬细胞(PMs)和极化外周血单核细胞(pPBMC)中的巨噬细胞变化,发现BWBDS处理减少了促炎M1型巨噬细胞数量,同时增加了抗炎M2型巨噬细胞比例。特别是IL-10+ M2型巨噬细胞的产生显著增加,表明BWBDS通过促进巨噬细胞抗炎活性发挥保护作用(图2)。
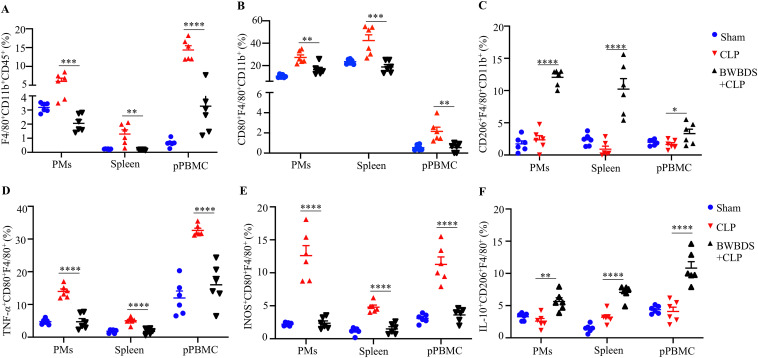
图2.八味败毒散抗SILI作用与促进巨噬细胞抗炎活性有关
3. 重塑肠道菌群组成
研究通过肠杆菌基因组内重复序列一致性PCR(enterobacterial repetitive intergenic consensus-PCR)和16S PacBio SMRT测序技术,深入分析了BWBDS对脓毒症模型小鼠肠道菌群组成的影响(图3)。菌群多样性分析显示,BWBDS处理组小鼠的肠道菌群组成与对照组存在显著差异。BWBDS选择性促进了肠道中约翰逊乳杆菌(L. johnsonii)的生长。
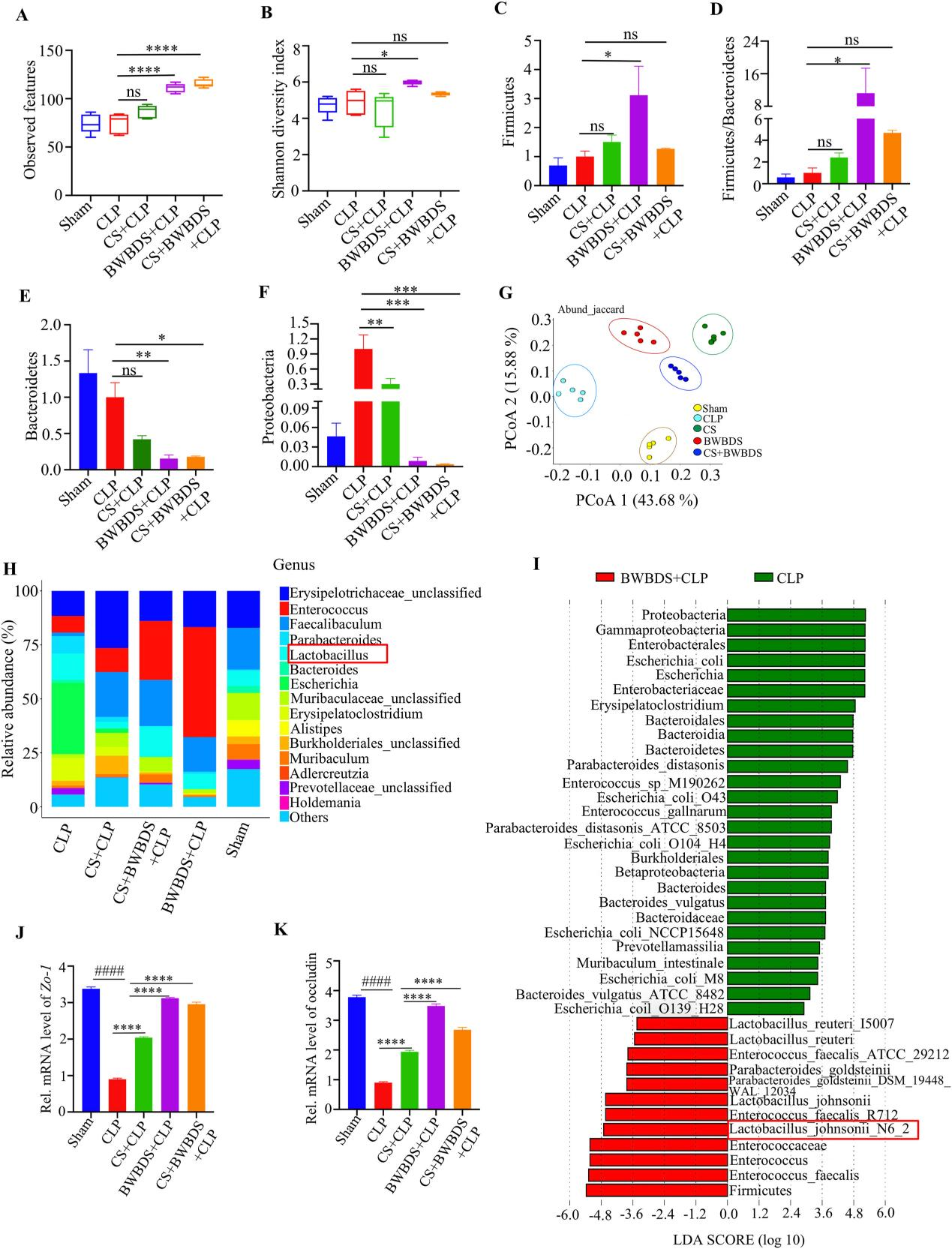
图3.八味败毒散治疗小鼠和CLP对照组小鼠的肠道菌群组成不同
4. 粪便移植验证菌群作用
粪便移植(FMT)实验发现BWBDS粪便小鼠受体在CLP后的存活率高于CLP粪便接受组(图4),受体小鼠也表现出对SILI的保护作用,证实了肠道菌群在BWBDS抗脓毒症效应中的关键作用。
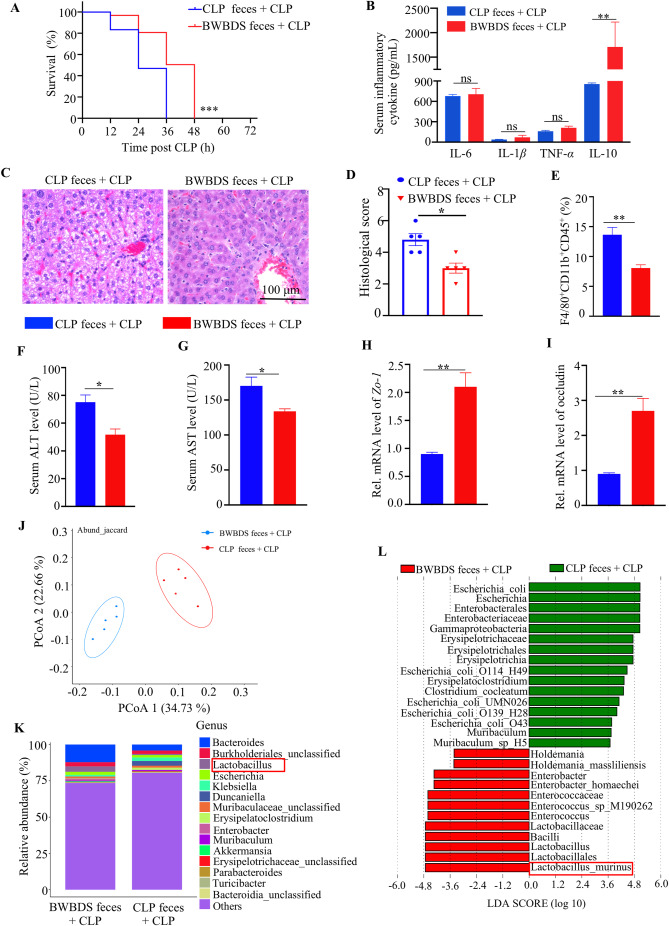
图4.BWBDS治疗小鼠的肠道微生物区系可独立减轻SILI
5.约氏乳杆菌L.johnsonii改善败血症引起的肝损伤
进一步验证复方处理后显著增加乳杆菌的作用,口服约氏乳杆菌治疗可显著延长术后的存活率。单独补充约翰逊乳杆菌即可显著缓解SILI,效果甚至优于BWBDS处理组。值得注意的是,即使是热灭活的约翰逊乳杆菌也能发挥类似的保护作用(图5)。结果表明约氏乳杆菌可以和BWBDS一样减轻败血症引起的肝损伤。
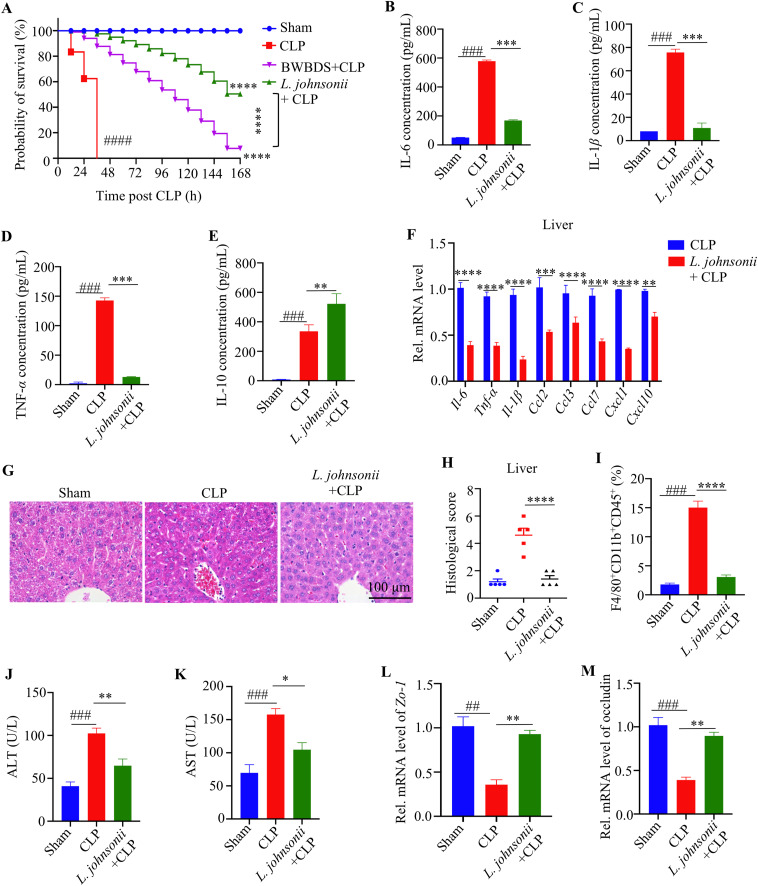
图5. 约氏乳杆菌L. johnsonii治疗可独立缓解 SILI
总结:
本研究为脓毒症中的“肠-肝-免疫轴”提供了新的见解。八味败毒散通过增加肠道微生物群约氏乳杆菌L. johnsonii,帮助维持肠道完整性和促进巨噬细胞抗炎活性来缓解败血症性肝损伤(SILI)。此外,L. johnsonii通过增强肠道完整性和促进M2巨噬细胞抗炎症活性来缓解SILI。作者的研究结果表明,八味败毒散可以作为益生元,而肠道微生物群约氏乳杆菌可以作为益生菌用于败血症患者,以改善SILI。
 技术咨询:
技术咨询: